Conceito
Gases são moléculas ou átomos que se movimentam constantemente.
Gases são moléculas ou átomos que se movimentam constantemente.
Dentre as suas características, podemos destacar volume variável, difusibilidade e compressibilidade.

Ilustração de moléculas de gás carbônico. Assim como ele, a maioria dos gases é formada por moléculas.
O estado gasoso é um dos três estados físicos da matéria, por isso é muito importante entender a constituição, propriedades e características dos gases porque eles estão muito presentes em nosso cotidiano, sendo, inclusive, indispensáveis para os vegetais e animais, bem como para o desenvolvimento da sociedade, pois influenciam campos como o da indústria e o dos meios de transportes. Os gases são compostos por moléculas e átomos, como por exemplo:

Exemplos de gases moleculares
Agora falando de gases formados por átomos, isso ocorre somente no caso dos gases nobres (pertencentes à família 18 da tabela periódica). Entre eles, temos o gás hélio (He), que é usado para encher balões e no tratamento de asma junto ao oxigênio, pois assim se reduz o esforço muscular da respiração; e o gás neônio (Ne), que é muito usado em letreiros luminosos, pois, quando se passa uma descarga elétrica nesse gás em um tubo a baixa pressão, ele emite uma coloração laranja-avermelhada (daí a origem do termo “neon”). Vale destacar que os que são de outras cores não contêm o neônio, mas sim outros gases.

Exemplos de aplicações dos gases hélio e neônio
Visto que não podemos ver as moléculas e os átomos que formam os gases, os cientistas, a partir do método científico, mencionado anteriormente, a teoria geral do gás ideal, onde explica-se o comportamento dos mesmos.
Por volta do século XVII e XIX, três cientistas (Jacques Charles, Louis J. Gay-Lussac e Paul E. Clayperon), após estudarem o comportamento dos gases, elaboraram leis que regem o comportamento dos gases perfeitos, também chamados de gases ideais. As leis por eles determinadas estabelecem as regras do comportamento “externo” do gás perfeito, levando em conta apenas as grandezas físicas que estão associadas a eles, grandezas essas que são: volume, temperatura e pressão.
A expressão que determina a lei geral para os gases perfeitos pode ser vista da seguinte forma:
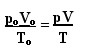
Onde po, Vo e To são respectivamente a pressão inicial, volume inicial e temperatura inicial. Essa é uma expressão que é utilizada para quando as variáveis de um gás apresentar variações.
Robert Boyle, físico e químico, foi quem determinou a lei que rege as transformações sofridas por um gás, quando sua temperatura é mantida constante. Sua lei diz que quando um gás sofre uma transformação isotérmica, a pressão dele é inversamente proporcional ao volume ocupado. Dessa lei obtemos que como To= Ttemos que:
poVo = pV
A lei de Charles é a lei que rege as transformações de um gás perfeito a volume constante. Essas transformações são chamadas de transformações isocóricas ou isométricas. Segundo essa lei, quando uma massa de gás perfeito sofre transformação isocórica, a sua pressão é diretamente proporcional à sua temperatura absoluta. Matematicamente essa lei pode ser expressa da seguinte forma:
![]()
Onde po e To são respectivamente a pressão inicial e a temperatura inicial.
A lei de Gay-Lussac é a lei que rege as transformações de um gás perfeito à pressão constante. Essa lei, apesar de levar o nome de Gay-Lussac, já havia sido descoberta pelo físico e químico A.C. Charles. Segundo a lei, quando um gás sofre uma transformação isobárica o volume do gás é diretamente proporcional à sua temperatura absoluta. Matematicamente essa lei pode ser expressa da seguinte forma:
![]()
Onde Vo e To correspondem respectivamente ao volume inicial e à temperatura inicial.