Iremos mostrar o comportamento das principais propriedades periódicas (propriedades que variam periodicamente em função de seus números atômicos).
Raio atômico
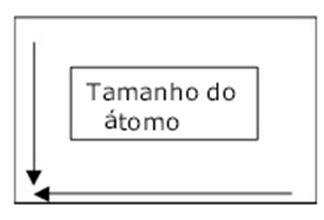
Cresce para baixo e para a esquerda.
Raio iônico
O raio do átomo é sempre maior do que o raio do seu respectivo cátion.
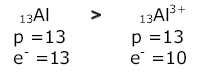
No cátion que se forma os elétrons são fortemente atraídos pela carga nuclear que é maior, diminuindo o tamanho do íon. O raio do átomo é sempre menor do que o raio do seu respectivo ânion.
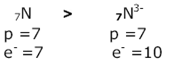
A energia mínima necessária para remover um elétron de um átomo ou íon no estado gasoso é chamado de Afinidade Eletrônica.
Esse elétron é sempre retirado da última camada eletrônica, que é a mais externa e é conhecida como camada de valência.
Quanto maior o raio atômico, mais afastados do núcleo os elétrons da camada de valência estarão, a força de atração entre eles será menor e, consequentemente, menor será a energia necessária para retirar esses elétrons e vice-versa. Por isso, a energia de ionização dos elementos químicos na Tabela Periódica aumenta no sentido contrário ao aumento do raio atômico, isto é, de baixo para cima e da esquerda para a direita:

Ordem de crescimento da energia de ionização na Tabela Periódica
A tendência que um átomo tem de atrair elétrons para si em uma ligação química covalente em uma molécula isolada se chama Eletronegatividade.
Os valores das eletronegatividades dos elementos foram determinados pela escala de Pauling.
Foi observado que, conforme o raio aumentava, menor era atração do núcleo pelos elétrons compartilhados na camada de valência. Por isso, a eletronegatividade também aumenta no sentido contrário ao aumento do raio atômico, sendo que varia na Tabela Periódica de baixo para cima e da esquerda para a direita:
