Os elétrons da eletrosfera distribuem-se em sete camadas eletrônicas que são designadas pelas letras do alfabeto: K, L, M, N, O, P e Q.
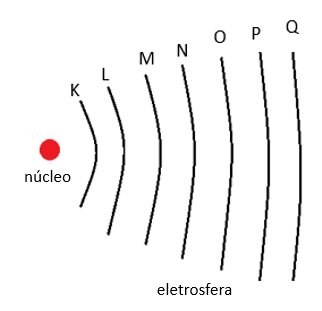
Os elétrons de cada uma das camadas possuem uma quantidade de energia sempre inferior à da camada seguinte. A quantidade de energia dos elétrons determina um nível de energia que recebe um valor numérico denominado número quântico.
Cada número quântico corresponde a uma camada eletrônica.
|
CAMADA |
Nº MAX. ELET. |
|
K |
2 |
|
L |
8 |
|
M |
18 |
|
N |
32 |
|
O |
32 |
|
P |
18 |
|
Q |
2 |
Seja qual for a última camada de um átomo, ele nunca pode possuir mais de 8 elétrons. A penúltima camada geralmente tem 8 ou 18 elétrons. Quando um átomo se combina com outro, há uma tendência a completar-se o n° máximo de elétrons da última camada.
Veja abaixo a distribuição eletrônica de Linus Paulin:
Lendo o diagrama, seguindo as setas você obterá a ordem de energia crescente dos subníveis.

DISTRIBUIÇÃO DE LINUS PAULING
Exemplo:
17Cl: 1s2 2s2 2p6 3s2 3p5
17Cl-1: 1s2 2s2 2p6 3s2 3p6
O nível com maior quantidade de elétrons é chamado nível mais energético, a partir dele é possível prever o período onde o elemento vai estar localizado na tabela periódica e seu subnível correspondente, diz a família da certa espécie química. No nosso exemplo o Cloro tem 7 elétrons no nível 3, é o mais energético. Logo o Cl se encontra no 3° período na família 7A, mais conhecida como família dos halogênios.
O nível mais externo ao átomo é chamado de camada de valência. É importante ressaltar que é na camada de valência onde ocorrem as ligações químicas, logo é muito importante conhecer qual é e quantos elétrons ela tem, em cada caso.
ISÓTOPOS
São átomos do mesmo elemento químico, com o mesmo número atômico (prótons representado por Z), porém n° de massa (prótons + nêutrons, representado por A) diferentes.
Ex: O carbono 12 é isótopo do carbono 14, porque o 12 tem Z = 6 e A = 12, e o 14 tem Z = 6 e A = 14.
ISÓBAROS
São átomos com diferentes n° atômicos. Portanto, pertencem a elementos químicos diferentes, mas tem o mesmo número de massa.
Ex: O potássio 40 é isóbaro do cálcio 40, porque o potássio 40 tem Z = 19 e A = 40, e o cálcio 40 tem Z = 20 e A = 40.
ISÓTONOS
São átomos de elementos químicos diferentes, de diferentes números atômicos, diferentes números de massa, e mesmo número de nêutrons.
Ex: o hidrogênio 3 é isótono do hélio 4, porque o H tem Z = 1 e A = 3, então tem 2 nêutrons (A - Z), e o hélio tem Z = 2 e A = 4, então também tem 2 nêutrons.
NÚMERO DE MASSA
A característica fundamental que define um elemento químico é o número de prótons (Z) no núcleo.
Se chamarmos de N o número de nêutrons no núcleo, o número de massa A é dado por: A = Z + N. Ou seja, a soma do número de prótons com o de nêutrons.