DIFERENÇA ENTRE ÁTOMO E ÍON
Os átomos são a espécie química mais elementar que é capaz de participar de uma reação e formar compostos ou substâncias. Por exemplo: o átomo de oxigênio ao combinar-se com outro, forma a substância oxigênio. Assim como, ao combinar-se com o carbono forma o composto monóxido de carbono.
Representação artística do átomo de Bohr
Íons são espécies químicas originadas de átomos com deficiência ou excesso de elétrons. Assim, possuem carga elétrica positiva (denominados cátions) ou negativa (ânions) e são capazes de formar compostos sólidos (como sais) por simples atração eletrostática (utilizando-se das Leis de Coulom para a força elétrica).
A massa de um íon é praticamente a mesma de seu átomo correspondente (pois, como o elétron é mais de 1800 vezes mais leve que o próton, a diferença de massa é insignificante caso ocorra sua perda ou ganho).
Os compostos iônicos são formados pela atração de íons de carga oposta, apresentando, então, carga total neutra (Ex.: cloreto de sódio – NaCl). Geralmente, são sólidos nas condições ambiente e possuem altos pontos de fusão e ebulição.
Quando um íon não é elementar, mas um arranjo de outros íons envolta de um central ou um íon central rodeado de moléculas neutras, denomina-se complexo. Onde, mesmo que se assemelhe geometricamente a uma molécula, é dotado de carga total diferente de zero. Normalmente, um cátion metálico (de transição ou não) assume a posição central do complexo.
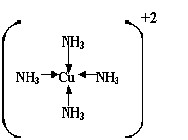
Estrutura de Lewis para o cátion complexo Tetraminocuprato (II)
COMPOSIÇÃO DO ÁTOMO
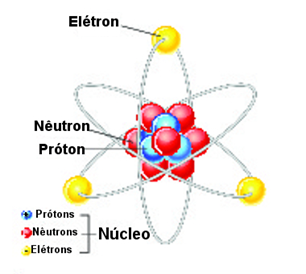
Segundo o modelo do átomo de Bohr, sua estrutura basicamente duas regiões distintas. O Núcleo É uma região maciça, compacta e densa que fica no centro do átomo. O núcleo atômico é divisível, pois é constituído de duas partículas diferentes:
Prótons: são partículas carregadas positivamente com carga relativa igual a +1. Sua massa relativa também é de 1.
O número de prótons existente no núcleo é chamado de número atômico (Z) que é o responsável pela diferenciação de um elemento químico de outro, ou seja, cada elemento químico é formado por um conjunto de átomos que possui o mesmo número atômico ou a mesma quantidade de prótons.
Nêutrons: como o próprio nome indica, essas são partículas neutras, isto é, não possuem carga elétrica. Assim, os nêutrons diminuem a força de repulsão entre os prótons no núcleo (tendo em vista que cargas de mesmo sinal repelem-se).
Essas partículas subatômicas possuem a massa relativa praticamente igual à dos prótons, isto é, 1. Mas, na realidade, a massa do nêutron é um pouco maior que a do próton. Isso é interessante porque, se fosse o contrário, isto é, se os prótons fossem ligeiramente mais pesados do que os nêutrons, todos os prótons seriam transformados em nêutrons. O resultado seria que, sem os prótons, os átomos não existiriam.